 Son procesos mediante los cuales algunas sustancias que reciben el nombre de reactivos se transforman en otras que tienen propiedades distintas y que se denominan productos.
Son procesos mediante los cuales algunas sustancias que reciben el nombre de reactivos se transforman en otras que tienen propiedades distintas y que se denominan productos.
Cuando se produce una reacción química los enlaces que existen entre los átomos y que componen los reactivos tienden a romperse. Luego, esos átomos se reorganizan de otra forma, creando nuevos enlaces y produciendo sustancias muy diferentes a las que tenían inicialmente. En una reacción química se desprende y también se puede absorber energía.
Las reacciones químicas se llevan a cabo en el momento en que desaparecen algunos elementos o sustancias y se forman otras.
El óxido de hierro, por ejemplo, es el resultado de una reacción química que se produce al poner el oxígeno que contiene el aire en contacto con el hierro.Otro ejemplo de reacción química lo constituye el agua, cuando se transforma en sus tres estados: Sólido, líquido y gaseoso. El agua también se transforma en hidrógeno y además en oxígeno.
Mientras, el hidrógeno reacciona ante el dióxido de carbono y forma el almidón. Cuando se enciende un fósforo se produce la combustión que es también una reacción química. Si se coloca un clavo a la intemperie y se oxida también se produce este tipo de reacción química.
Tipos de reacciones químicas
Reacción química exotérmica
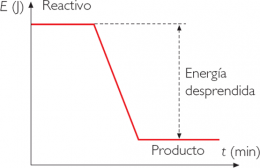 En esta reacción química se tiende a desprender energía mientras se produce la reacción.
En esta reacción química se tiende a desprender energía mientras se produce la reacción.
Reacción química endotérmica
En este tipo de reacción se absorbe energía al momento de producirse la reacción.
Reacción de síntesis o combinación directa
También se denomina de combinación directa. Es una reacción en la que se unen dos sustancias para la formación de un solo producto.
Reacción de descomposición

Son las que, partiendo de un solo compuesto, se pueden formar dos o más sustancias. Los átomos que forman el compuesto se dividen dando lugar a nuevas sustancias.
Reacción de desplazamiento
También se denominan reacciones de sustitución. En estas reacciones una sustancia, que forma parte de un compuesto, se sustituye por otra que es parte de la reacción.
Reacción de doble desplazamiento
También se denomina metátesis o de doble descomposición. En este tipo de reacción intervienen dos elementos, cada uno en una solución líquida o acuosa. Dos elementos que tienen compuestos distintos se unen e intercambian sus posiciones, para formar dos compuestos nuevos.
Oxido
En este tipo de reacción química que se presenta en la vida cotidiana, en metales como el hierro, se combina un compuesto constituido por el oxígeno conjuntamente con otros elementos. Un ejemplo claro de oxidación se produce en la manzana, que con solo segundo de darle una mordida, de inmediato se oxida.
Ácidos
Son sustancias que cuando están diluidas incrementan la cantidad de iones de hidrógeno que se encuentren concentrados. Si estos ácidos se combinan con elementos bases pueden producir sales.
Fotosíntesis
 Es un tipo de reacción química que se realiza de forma cotidiana, en donde las plantas logran obtener todos sus nutrientes partiendo principalmente del agua, las sales minerales y del dióxido de carbono ; para lo cual utilizan la energía del sol y también la clorofila.
Es un tipo de reacción química que se realiza de forma cotidiana, en donde las plantas logran obtener todos sus nutrientes partiendo principalmente del agua, las sales minerales y del dióxido de carbono ; para lo cual utilizan la energía del sol y también la clorofila.
Hidróxidos
Estos compuestos químicos son la resultante de unir un metal, con diferentes aniones de hidróxidos, en vez de oxígeno y un catión.
Ion
Es un átomo o también una molécula que tiene carga eléctrica.
Anión
Es una molécula o átomo que tiene carga eléctrica negativa.
Catión
Es un átomo o molécula con carga positiva.
Reacciones de combinación química
- Metal más Oxígeno da como resultado un óxido metálico.
- Un no metal más un oxígeno tiene como resultante un óxido no metálico.
- Un metal más un no metal dan como resultado sal.
- Agua más un óxido metálico dan como resultado una base.
- Agua más un óxido no metálico da como resultado oxiácido.
Ley de la conservación de las masas
Esta ley indica que la suma de las masas en los reactivos tiene que ser igual a suma de las masas que tienen los productos.